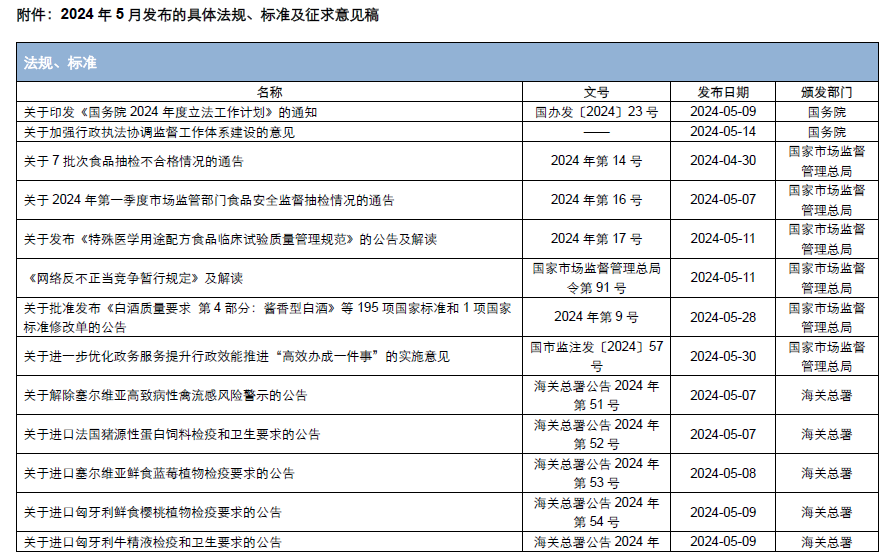
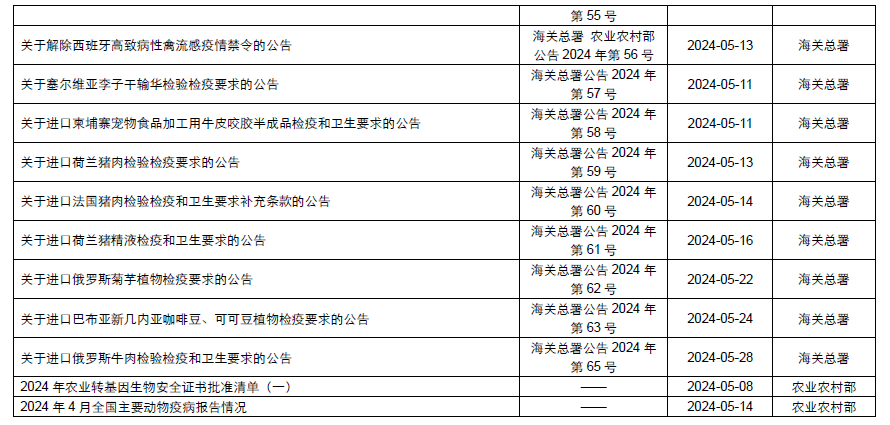
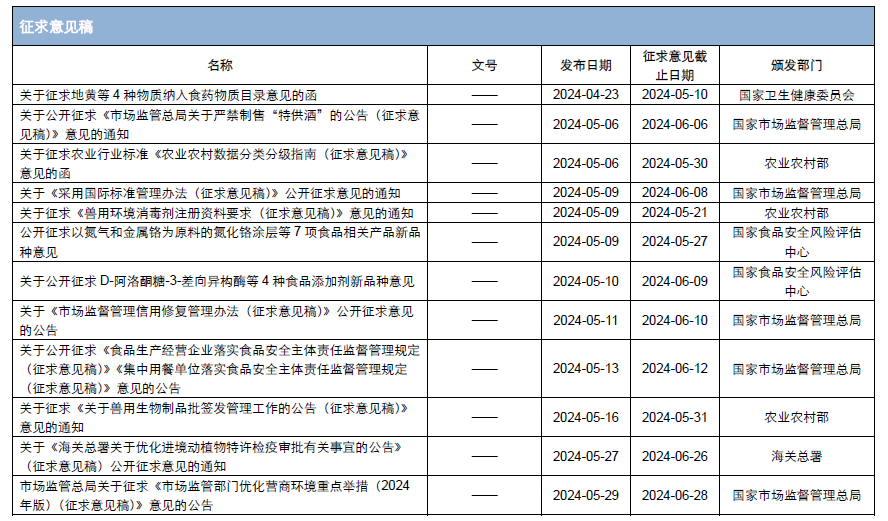
本月,各政府監管機構陸續發布了一些(xiē)食品相關的重要法規标準、征求意見稿及公告。其中,國務院發布《國務院2024年度立法工作(zuò)計(jì)劃》;國家(jiā)市場(chǎng)監督管理(lǐ)總局發布《特殊醫(yī)學用途配方食品臨床試驗質量管理(lǐ)規範》、《網絡反不正當競争暫行(xíng)規定》,并對《市場(chǎng)監管總局關于嚴禁制(zhì)售“特供酒”的公告(征求意見稿)》等公開(kāi)征求意見;國家(jiā)衛生(shēng)健康委員會(huì)發布關于征求地黃等4種物質納入食藥物質目錄意見的函;國家(jiā)食品安全風險評估中心對D-阿洛酮糖-3-差向異構酶等4種食品添加劑新品種公開(kāi)征求意見。
為(wèi)了更好地幫助企業落地法規,中食安信對2024年5月份發布的重點法規、标準以及征求意見稿進行(xíng)了簡單解讀,同時(shí)對本月發布的食品相關法規、标準等進行(xíng)了彙總,供大(dà)家(jiā)參考。
一、地黃、麥冬、化橘紅、天冬拟納入食藥物質目錄
2024年4月23日,國家(jiā)衛生(shēng)健康委員會(huì)發布關于征求地黃等4種物質納入食藥物質目錄意見的函,對地黃、麥冬、化橘紅、天冬4種物質拟納入按照傳統既是食品又是中藥材的物質(簡稱食藥物質)目錄定向征求意見。
拟新增的4種食藥物質分别在多(duō)省具有(yǒu)作(zuò)為(wèi)食品原料安全食用的曆史,主要食用方法為(wèi)泡茶、煲湯等。衛健委已組織完成了4種物質的安全性審查,并在征求意見中詳細明(míng)确了食用部位和(hé)安全限量要求。征求意見截止到2024年5月10日。
截止到目前為(wèi)止,衛健委已公告的列入食藥目錄中的物質共102種。地黃、麥冬、化橘紅、天冬4種物質若能納入食藥物質目錄,将有(yǒu)利于推動食藥物質産業的經營管理(lǐ),拓寬消費市場(chǎng),促進整個(gè)食品行(xíng)業的健康發展。
二、《特殊醫(yī)學用途配方食品臨床試驗質量管理(lǐ)規範》發布
2024年5月11日,國家(jiā)市場(chǎng)監督管理(lǐ)總局發布《特殊醫(yī)學用途配方食品臨床試驗質量管理(lǐ)規範》(以下簡稱“《規範》”)及解讀。相比于原食藥總局發布的《特殊醫(yī)學用途配方食品臨床試驗質量管理(lǐ)規範(試行(xíng))》,《規範》主要修訂內(nèi)容包括五個(gè)方面:(一)調整整體(tǐ)框架,按照臨床試驗開(kāi)展順序設置章節,各章節又以臨床試驗全過程質量管理(lǐ)的主要內(nèi)容為(wèi)主線;(二)優化臨床試驗方案設計(jì)相關要求,對受試者人(rén)數(shù)和(hé)試驗周期不再作(zuò)具體(tǐ)數(shù)量要求;(三)細化臨床試驗方案和(hé)報告相關內(nèi)容,提高(gāo)試驗方案可(kě)行(xíng)性和(hé)臨床試驗報告質量;(四)強化受試者權益保護相關內(nèi)容,充分保障受試者的安全;(五)突出特醫(yī)食品臨床使用實際,強調試驗設計(jì)的科學性、合理(lǐ)性依據,為(wèi)産品研發和(hé)臨床試驗質量控制(zhì)提供更有(yǒu)針對性的參考。
《規範》的發布進一步完善了特殊醫(yī)學用途配方食品的臨床試驗過程,确保臨床數(shù)據結果的科學性和(hé)真實可(kě)靠性,維護受試者和(hé)消費者的安全與合法權益,推動特殊醫(yī)學用途配方食品的順利注冊,促進特殊醫(yī)學用途配方食品行(xíng)業的蓬勃發展。
三、嚴禁制(zhì)售“特供酒”公開(kāi)征求意見
2024年5月6日,國家(jiā)市場(chǎng)監督管理(lǐ)總局對《市場(chǎng)監管總局關于嚴禁制(zhì)售“特供酒”的公告(征求意見稿)》(以下簡稱“征求意見稿”)公開(kāi)征求意見。征求意見稿指出“特供”“專供”“內(nèi)供”等假冒僞劣酒類商品,損害黨政機關和(hé)軍隊形象,擾亂線上(shàng)線下市場(chǎng)秩序,欺騙誤導消費者,嚴禁生(shēng)産、銷售、經營、設計(jì)、制(zhì)作(zuò)、代理(lǐ)、發布、推銷、印刷含有(yǒu)“特供”“專供”“內(nèi)供”黨政機關和(hé)軍隊等類似标識內(nèi)容的酒類商品、廣告、宣傳、包裝等。
早在2013年,國管局等5部門(mén)聯合發布了《關于嚴禁中央和(hé)國家(jiā)機關使用“特供”“專供”等标識的通(tōng)知(以下簡稱“通(tōng)知”)》。相比于通(tōng)知來(lái)說,此次征求意見稿的規定更詳細,要求範圍更廣,更進一步地規範市場(chǎng)秩序,維護黨政機關和(hé)軍隊形象及消費者的合法權益。
四、4種食品添加劑新品種公開(kāi)征求意見
2024年5月10日,國家(jiā)食品安全風險評估中心發布關于公開(kāi)征求D-阿洛酮糖-3-差向異構酶等4種食品添加劑新品種意見。本次征求意見的食品添加劑新品種包括1種新供體(tǐ)菌的酶制(zhì)劑和(hé)2種新的生(shēng)産菌來(lái)源的母乳低(dī)聚糖(食品營養強化劑),分别為(wèi)瘤胃球菌(Ruminococcus sp. 5_1_39B_FAA)供體(tǐ)的D-阿洛酮糖-3-差向異構酶、大(dà)腸杆菌K-12 GI724和(hé)大(dà)腸杆菌K-12 MG1655來(lái)源的2’-岩藻糖基乳糖(2’-FL)以及大(dà)腸杆菌BL21 star(DE3)來(lái)源的乳糖-N-新四糖(LNnT)。征求意見截止時(shí)間(jiān)為(wèi)2024年6月9日。
中食安信希望通(tōng)過對五月法規回顧以及重點法規的解讀,對企業及行(xíng)業人(rén)員把握監管變化趨勢、合規宣傳産品有(yǒu)所幫助。中食安信可(kě)提供标準法規咨詢、行(xíng)業輿情監控、食品标簽審核等咨詢服務,有(yǒu)任何問題歡迎随時(shí)聯系我們(010-51301566)。
 京公網安備11010502045875
京公網安備11010502045875