
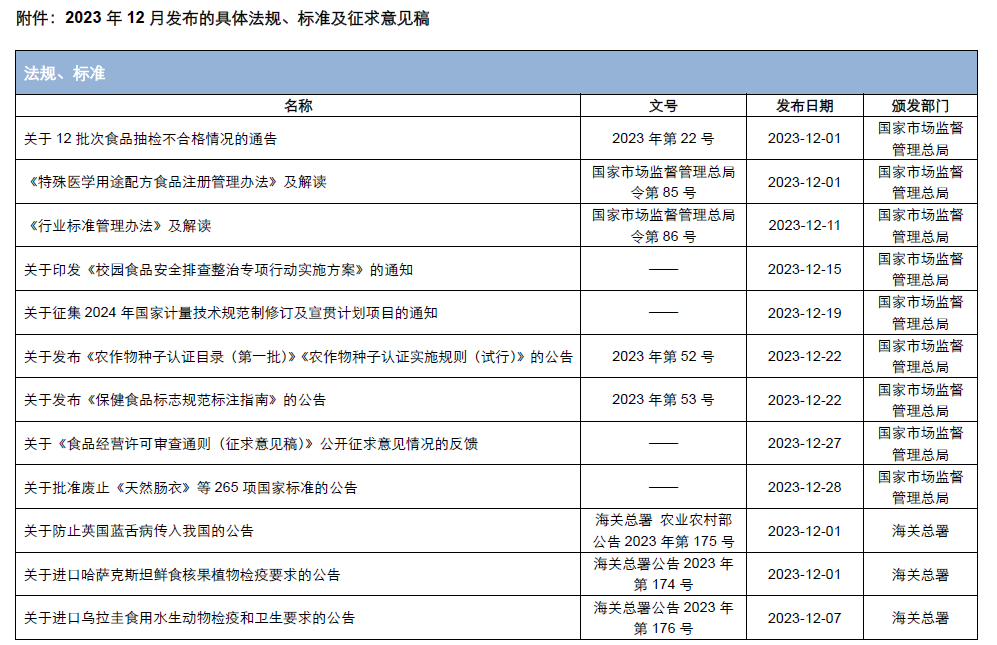
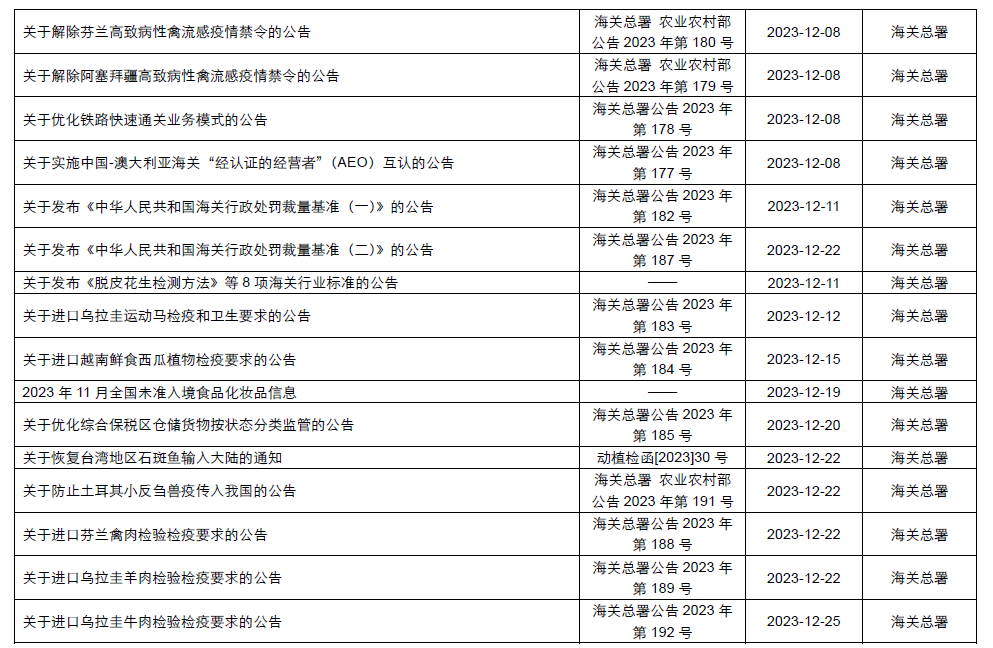
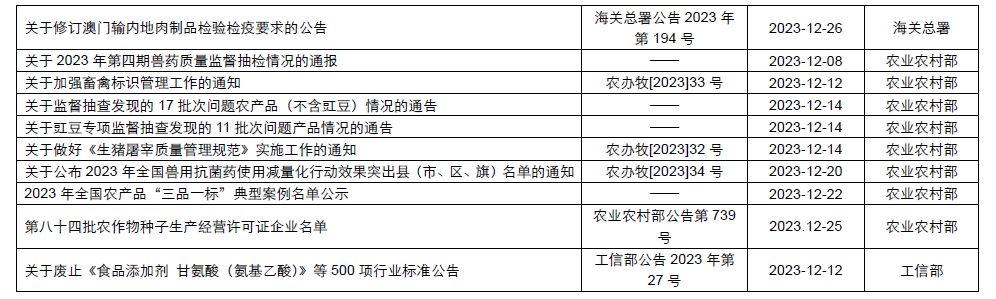
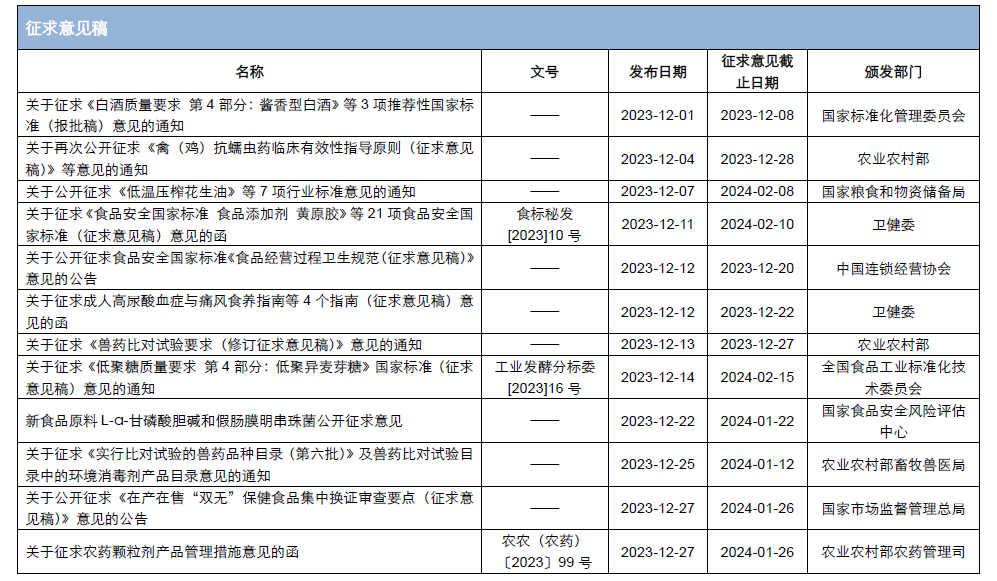
本月,各政府監管機構陸續發布了一些(xiē)食品相關的重要法規标準、征求意見稿及公告。其中,國家(jiā)衛生(shēng)健康委員會(huì)發布了關于征求《食品安全國家(jiā)标準 食品添加劑 黃原膠》等21項食品安全國家(jiā)标準(征求意見稿)意見的函;市場(chǎng)監管總局發布了《特殊醫(yī)學用途配方食品注冊管理(lǐ)辦法》及解讀、《行(xíng)業标準管理(lǐ)辦法》及解讀、《保健食品标志(zhì)規範标注指南》、關于公開(kāi)征求《在産在售“雙無”保健食品集中換證審查要點(征求意見稿)》意見的公告;國家(jiā)食品安全風險評估中心就新食品原料L-α-甘磷酸膽堿和(hé)假腸膜明(míng)串珠菌公開(kāi)征求意見。
為(wèi)了更好地幫助企業落地法規,中食安信對2023年12月份發布的重點法規、标準以及征求意見稿進行(xíng)了簡單解讀,同時(shí)對本月發布的食品相關法規标準等進行(xíng)了彙總,供大(dà)家(jiā)參考。
一、多(duō)項食品安全國家(jiā)标準公開(kāi)征求意見
2023年12月11日,《食品安全國家(jiā)标準 食品添加劑 黃原膠》等21項食品安全國家(jiā)标準(征求意見稿)的标準修改單公開(kāi)征求意見,包括食品添加劑1項:修訂《食品添加劑 黃原膠》;生(shēng)産經營規範3項:修訂《食品生(shēng)産通(tōng)用衛生(shēng)規範》、《保健食品良好生(shēng)産規範》;食品相關産品1項:修訂《食品接觸用塗料及塗層》;食品産品3項:修訂《巴氏殺菌乳》、《滅菌乳》,制(zhì)定《高(gāo)溫殺菌乳》。反饋截止日期為(wèi)2024年2月10日。
2023年12月1日,市場(chǎng)監管總局發布了《特殊醫(yī)學用途配方食品注冊管理(lǐ)辦法》與解讀文件,包括總則、申請(qǐng)與注冊、臨床試驗、标簽和(hé)說明(míng)書(shū)、監督檢查/監督管理(lǐ)、法律責任、附則七章共六十四條內(nèi)容。此次修訂與舊(jiù)版相比,嚴格了注冊要求,明(míng)确不予注冊情形;新增優先審評審批程序鼓勵企業研發注冊臨床急需、罕見病類别等特殊醫(yī)學用途配方食品,以滿足臨床需要,并設置了相應優先審評審批程序,明(míng)确适用範圍及政策支持措施。納入優先審評審批程序的産品,審評時(shí)限為(wèi)從六十個(gè)工作(zuò)日壓縮為(wèi)三十個(gè)工作(zuò)日。《辦法》于2024年1月1日起施行(xíng),2016年3月7日原國家(jiā)食品藥品監督管理(lǐ)總局令第24号公布的《特殊醫(yī)學用途配方食品注冊管理(lǐ)辦法》同時(shí)廢止。
三、保健食品标志(zhì)規範标注指南發布以及《在産在售“雙無”保健食品集中換證審查要點(征求意見稿)》公開(kāi)征求意見
2023年12月12日市場(chǎng)監管總局發布《保健食品标志(zhì)規範标注指南》(以下簡稱《指南》),指導保健食品生(shēng)産經營者進一步規範标注保健食品标志(zhì)。《指南》中保健食品專有(yǒu)标志(zhì)圖形、顔色與原規定原則保持一緻,明(míng)确了保健食品标志(zhì)框架、圖形比例等內(nèi)容。保健食品生(shēng)産經營者應切實履行(xíng)食品安全主體(tǐ)責任,按照《指南》規範标注保健食品标志(zhì),可(kě)在生(shēng)産經營場(chǎng)所、專區(qū)專櫃、廣告中使用保健食品标志(zhì);可(kě)按照法律法規規定,結合自身實際在保健食品産品運輸箱、中轉箱等包裝材料上(shàng)規範使用保健食品标志(zhì)。
2023年12月27日,為(wèi)規範原衛生(shēng)部等過去不同時(shí)期批準的“無有(yǒu)效期、無産品技(jì)術(shù)要求”(以下簡稱“雙無”)保健食品注冊證書(shū),完善注冊信息,統一監管标準,市場(chǎng)監管總局經廣泛征求意見,制(zhì)定本審查要點。規定在過渡期內(nèi),省級市場(chǎng)監管部門(mén)繼續按照現行(xíng)規定發放生(shēng)産許可(kě),持有(yǒu)效生(shēng)産許可(kě)的“雙無”産品集中換證,由生(shēng)産許可(kě)核發地省級市場(chǎng)監管部門(mén)出具換證意見。《要點》同時(shí)說明(míng)了詳細的換證程序以及具體(tǐ)要求,意見建議反饋截止時(shí)間(jiān)為(wèi)2024年1月26日。
四、2種新食品原料公開(kāi)征求意見,甜葉菊等3種新食品原料終止審查
2023年12月22日,新食品原料L-α-甘磷酸膽堿和(hé)假腸膜明(míng)串珠菌已通(tōng)過專家(jiā)評審委員會(huì)技(jì)術(shù)審查,現公開(kāi)征求意見,反饋截止時(shí)間(jiān)為(wèi)2024年1月22日。
L-α-甘磷酸膽堿推薦食用量≤600毫克/天,嬰幼兒、孕婦和(hé)哺乳期婦女不宜食用,标簽、說明(míng)書(shū)應當标注不适宜人(rén)群和(hé)食用限量,随公告附有(yǒu)其質量規格和(hé)食品安全指标;
假腸膜明(míng)串珠菌批準列入《可(kě)用于食品的菌種名單》,使用範圍包括發酵乳、風味發酵乳、幹酪、發酵型含乳飲料、乳酸菌飲料(非固體(tǐ)飲料)、稀奶油、奶油(黃油)和(hé)無水(shuǐ)奶油(無水(shuǐ)黃油),不包括嬰幼兒食品。
同時(shí),新食品原料終止審查目錄也發生(shēng)變化,甜葉菊、兩色金雞菊、金花(huā)茶花(huā)朵3種新食品原料終止審查。
甜葉菊的申報于2023年7月19日受理(lǐ),受理(lǐ)編号為(wèi)衛食新申字(2023)第0008号,由于其在我國多(duō)省具有(yǒu)長期人(rén)群食用曆史,建議終止審查,食品安全指标按照我國現行(xíng)食品安全國家(jiā)标準中葉菜蔬菜的規定執行(xíng)。
中食安信希望通(tōng)過對十二月法規回顧以及重點法規的解讀,對企業及行(xíng)業人(rén)員把握監管變化趨勢、合規宣傳産品有(yǒu)所幫助。中食安信可(kě)提供标準法規咨詢、行(xíng)業輿情監控、食品标簽審核等咨詢服務,有(yǒu)任何問題歡迎随時(shí)聯系我們(010-51301566)。
 京公網安備11010502045875
京公網安備11010502045875